NIVELACION TERCER PERIODO
LEYES DE LOS GASES

INTRODUCCIÓN:
En este blog se hablara sobre la ley de Boyle Y de Charles, sus conceptos, aplicación y ejercicios con los cuales podemos realizar un proceso correcto a la hora de hallar la relación entre la presión y el volumen de un gas o relación entre la temperatura y el volumen de un gas.
OBJETIVOS:
- Profundizar en los conceptos de temperatura, presión, volumen y cantidad de un gas.
- Reconocer las leyes de boyle y charles y su aplicación.
- Identificar la ecuación correcta al resolver un ejercicio dependiendo los datos dados.
CONCEPTOS:
- ESTADOS DE AGREGACIÓN:Los estados de agregación, sólido, líquido y gaseoso, dependen fundamentalmente de las condiciones de presión y temperatura a las que esté sometida la materia
- TEMPERATURA:Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
- PRESIÓN:En Física, llamamos presión a la relación que existe entre una fuerza y la superficie sobre la que se aplica:Dado que en el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2), la unidad resultante para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa)
- VOLUMEN:l volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas.En el laboratorio se utilizan frecuentemente jeringuillas como recipientes de volumen variable cuando se quiere experimentar con gases.
- CANTIDAD DE GAS:La cantidad de gas está relacionada con el número total de moléculas que se encuentran en un recipiente. La unidad que utilizamos para medir la cantidad de gas es el mol.Un mol es una cantidad igual al llamado número de Avogadro:1 mol de moléculas= 6,022·1023 moléculas1 mol de átomos= 6,022·1023 átomos¡¡¡ 602.200.000.000.000.000.000.000 !!!La masa molar de una sustancia pura es la masa que corresponde a 1 mol de dicha sustancia:Con el siguiente simulador puedes calcular las masas molares de algunas sustancias puras como el hidrógeno, el metano, el cloro y el yodo. La medida es correcta cuando se enciende el testigo rojo.
LEYES:
- LEY DE AVOGADRO:(Relación entre la cantidad de gas y su volumen)Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles.
- LEY DE BOYLE:Relación entre la presión y el volumen de un gas cuando la temperatura es constanteFue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
- LEY DE CHARLES:Relación entre la temperatura y el volumen de un gas cuando la presión es constanteEn 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
LABORATORIO:
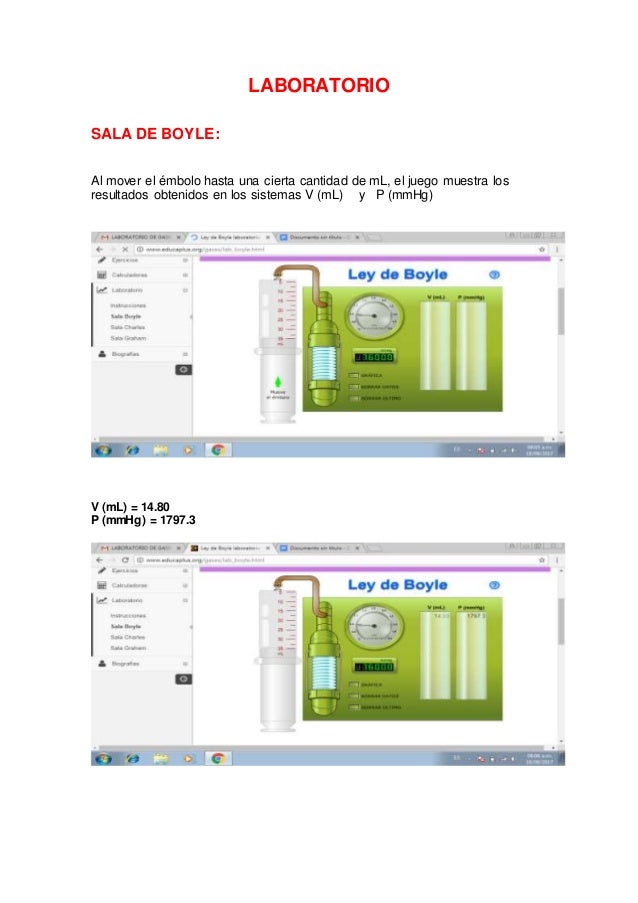
INSTRUCCIONES :





2870 mL * 1L = 2,87 L


V1 = V2
1030 mL * 1L = 1,03 L

V1*T2 =V2*T1
SALA DE BOYLE


SALA DE CHARLES

EJERCICIOS
EJERCICIOS LEY DE BOYLE

P1·V1 = P2·V2
P1V1= P2.V2
1,393 atmV1= 0,372 atm * 6047 mL
V1=1614,848 mL
1614,848 mL* 1L = 1,614 L
1000 mL

P1·V1 = P2·V2
V1P1= P2.V2
2845 mLP1= 3,54 atm * 5186 mL
P1= 6,452 atm
EJERCICIOS GASES IDEALES

P.V = n.R.T
n*RT= P * V
0,49 mol * 0,082 atm L
T= 1,21 atm * 8,87 L
T= 1,21 atm * 8,87 L
mol °K
T= 268,3 °K
2870 mL * 1L = 2,87 L
1000 mL

P.V = n.R.T
n*Rn= P * V
0,082 atm L * 160,98 °kn= 1,26 atm * 9 L
mol °K
n= 0,85 moles
EJERCICIOS LEY DE CHARLES

V1 = V2
-----------
T1 T2
V1*T2 =V2*T1
T2V1= V2.T1
343,4 °KV1= 1,03 mL * 876,8 °K
V1 = 2,63 mL
1030 mL * 1L = 1,03 L
1000 mL

V1 = V2
---------------
T1 T2
V1*T2 =V2*T1
V2T1= V1.T2
T1= 3,41 L * 2170,7 °K
8,33 L
T1 = 888,6 °K
888,6 °K – 273,15 = 615,45 °C




FALTO INTRODUCCION, PB JETIVOS Y LOS EJERCICIOS 3.0
ResponderEliminar