
QUE ES UNA REACCIÓN QUÍMICA?
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de cada una de las reacciones se le denomina ecuación química.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total
EJEMPLOS:
Reacción química ácido base:
- 2HCl + Zn –> ZnCl2 + H2
- NaOH + HCL –> NaCl + H2O
- Fe(OH)2 + H2SO4 –> FeSO4 + H2O
- CuO + 2HCL –> CuCl2 + H2O
Reacción química de combustión:
- O2 + C –> CO2
- 2SH2 + 3O2 –> 2SO2 + 2H2O
- Cu + O2 –> CuO2
Reacción química de oxidación:
- 2Fe + O2 = 2FeO
- 4Al + 3O2 = 2Al203
- 2Mg + O2 –> 2MgO
- CH3-(CH2)3-CH2-CL+ Na-CN, se obtiene Cloruro de pentano.
- CH3 (CH2)3 CH2CN+NaCL. Se obtiene Cianuro de pentano.
- LiCL+CH3 CH2 CH2 SH. Se obtiene Propanotinol.
- CH3 CH2 CH2 CL+Na OHaq. Se obtiene Cloruro de butilo.
- CH3 CH2 CH2 CH2 OH+NaCI. Se obtiene alcohol butílico.
- CH3 CH2 CH2 CL+Li SH se obtiene cloro propano.
- LiCI+CH3 CH2 CH2 SH. Se obtiene Propantiol.
- Na2CO3 + H2O + CO2 <–> 2 NaHCO3.
- Cr2O3 + 2 Al <–> Al2O3 + 2 Cr.
- CuFeS2 + 3 O2 <–> 2 SO2 + CuO + FeO.
- CH3-CH=CH2 con KMnOH, OH- obteniendo una cetona.
QUE ES UNA ECUACIÓN QUÍMICA :
Una reacción química es cualquier proceso en el que, por lo menos, los átomos, las moléculas o los iones de una sustancia se transforman en átomos, moléculas o iones de otra sustancia química distinta. Las reacciones químicas se escriben de forma simplificada mediante ecuaciones químicas.
En las reacciones químicas se cumple la ley de conservación de la masa, teniendo lugar una reordenación de los átomos, pero no su creación ni su destrucción. El reordenamiento de los átomos en la molécula da lugar a una sustancia distinta.
Las sustancias que se transforman o modifican en una reacción se llaman reaccionantes, reactivos o reactantes. Las sustancias nuevas que se originan en una reacción química se llaman productos.
EJEMPLOS:
EJEMPLOS:
- H2+ O2 <--> H20
- N2 + H2 <--> NH3
- H2O + Na <--> Na(OH) + H2
- KClO3 <--> KCl + O2
- BaO2 + HCl <--> BaCl2 + H2O2
- H2SO4 + NaCl <--> Na2SO4 + HCl
- FeS2 <--> Fe3S4 + S2
- H2SO4 + C <--> H20 + SO2 + CO2
- SO2 + O2 <--> SO3
- NaCl <--> Na + Cl2
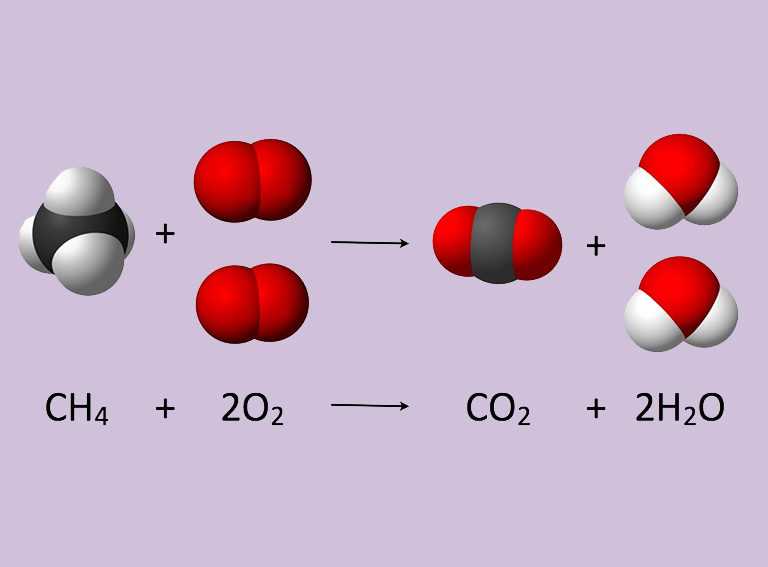
COMO SE ESCRIBE UNA ECUACIÓN QUÍMICA?
ESTOS SON LOS PASOS
- Los reactivos se separan de los productos con una flecha (
) que indica el sentido de la reacción. Una flecha doble (
) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
- Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo (+) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
- Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula (
) colocada sobre la flecha (
) indica que se suministra calor a la reacción.
- Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
- El estado físico de la sustancias se indica mediante los siguientes símbolos: (s) para el estado sólido; (l) para el estado líquido; (g) para el estado gaseoso; y (ac) para las sustancias en solución acuosa.
- Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
- Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
- Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
- Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el SO4-2 se ajusta como ion sulfato y no como átomos de S y átomos de O.
- Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique.
FALTO BALANCEO 3.0
ResponderEliminarCORRECCION NIVELACION PUDO CONSULTAR MÀS 4.3
ResponderEliminar